17.10.2025 — ВСОШ Школьный этап по Химии: задания и ответы для 77 региона
Авторские решения к этой работе доступны для покупки на нашем сайте:
Сегодня рассмотрим задания и решения по Химии для 7–11 классов:
Навигация
7-8 класс
Задание 1. Пламя становится светящимся из-за образующихся в нем раскаленных твердых частиц. Если образующихся частиц слишком много, то они не успевают нагреться в пламени до белого каления, такое пламя коптит. Определите, какие из веществ при сгорании на открытом воздухе дают светящееся или коптящее пламя.
- сера
- бензин
- магний
- водород
- метан
- фосфор
Ответ: сера, метан, магний, фосфор, водород, бензин
Задание 2. На планете Плюк в соседней галактике Периодическая система такая же, как на Земле, но атомная единица массы у них ровно в 3 раза больше.
Чему равна относительная молекулярная масса воды на Плюке?
Задание 3. Какие величины совпадают на Плюке и на Земле?
Ответ: Все совпадают
- атомная доля водорода в воде
- относительная атомная масса кислорода
- массовая доля водорода в воде
- относительная молекулярная масса серной кислоты
Ответ: Все совпадают
Задание 4. Для создания произведений искусства используют различные химические вещества. Из чего сделаны изображенные ниже скульптуры? Установите правильное соответствие.

- Памятник А.С. Пушкину, Москва
- Венера Милосская, Лувр, Париж
- Малахитовая чаша, Эрмитаж, Санкт-Петербург
- «Маша и Медведь»
- Cu+Sn
- (CuOH)2CO3
- SiO2
- CaCO3
Ответ: Памятник А.С. Пушкину, Москва → Cu + Sn Венера Милосская, Лувр, Париж → CaCO3 Малахитовая чаша, Эрмитаж, Санкт-Петербург → (CuOH)2CO3 «Маша и Медведь» → SiO2
Задание 5. Один из самых красивых драгоценных камней – изумруд – описывается формулой Be3Al2Si6Ox.

Представьте состав изумруда в виде комбинации оксидов. Запишите числа a, b, c в формуле aBeO⋅bAl2O3⋅cSiO2. Если встретится единичный коэффициент, его тоже указывайте.

Задание 6. Найдите xx в формуле Be3Al2Si6Ox.
Задание 7. Пероксидами называют производные пероксида водорода H2O2, в котором атомы водорода замещены на атомы металла в соответствии с их валентностью.
Запишите химическую формулу пероксида бария.
Задание 8. При нагревании смеси магния с пероксидом бария происходит яркая вспышка. Продуктами химической реакции являются два сложных твёрдых вещества. Запишите их химические формулы.
Задание 9. На картинке приведена диаграмма, описывающая состав сухого воздуха в объёмных процентах. Сделайте выводы из этой диаграммы. Для каждого из приведенных ниже утверждений укажите, верное оно или нет.
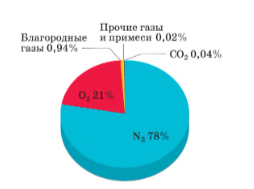
- Воздух – это смесь газов.
- Воздух почти полностью (больше, чем на 99,9%) состоит из простых веществ.
- В составе сухого воздуха совсем нет сложных веществ.
- Основной компонент воздуха по объёму – азот.
- Основной компонент воздуха по массе – кислород.
- 99% воздуха – это двухатомные молекулы.
- В составе воздуха не менее 5 веществ.
Задание 10. В каком простом веществе массовая доля водорода наибольшая? Запишите формулу вещества и массовую долю водорода в процентах.
Формула –
Массовая доля водорода = %
Задание 11. В каком сложном веществе массовая доля водорода наибольшая?
Подсказка: при обычных условиях вещество газообразное.
Запишите формулу вещества и массовую долю водорода в нём в процентах с точностью до целых.
Формула –
Массовая доля водорода = %
Задание 12. Известно, что кремний реагирует с газообразным азотом в массовом соотношении 3:2, при этом образуется единственный продукт – вещество X.
Запишите химическую формулу X.
Задание 13. Вещество XX при нагревании в кислороде сгорает, образуя одно простое и одно сложное вещество.
Запишите формулы этих веществ.
Простое вещество –
Сложное вещество –
Задание 14. При длительном нагревании порошка металла осмия (Δr = 100) в кислороде не остаётся твёрдого остатка, так как оксид осмия летуч. Известно, что в этом оксиде масса осмия почти в три раза больше массы кислорода.
Запишите химическую формулу этого оксида.
→ Получить ответы
Задание 15. Порошок сплава осмия с платиной массой 29,0 г после длительного прокаливания на воздухе стал весить 19,5 г.
Определите массовую долю осмия в сплаве в процентах. Ответ округлите до целого числа.
→ Получить ответы
Задание 16. Сколько атомов платины приходится в этом сплаве на один атом осмия? Ответ округлите до целого числа.
→ Получить ответы
Запишите химическую формулу этого оксида.
→ Получить ответы
Задание 15. Порошок сплава осмия с платиной массой 29,0 г после длительного прокаливания на воздухе стал весить 19,5 г.
Определите массовую долю осмия в сплаве в процентах. Ответ округлите до целого числа.
→ Получить ответы
Задание 16. Сколько атомов платины приходится в этом сплаве на один атом осмия? Ответ округлите до целого числа.
→ Получить ответы
9 класс
Задание 1. На картине Л.З. Танклевского «Портрет химика Алексея Ивановича Шаврыгина» показано, как учёный измеряет показатель преломления перегоняемой жидкости на рефрактометре. Соотнесите названия лабораторной посуды с номерами, которыми она обозначена на рисунке.

- 1
- 2
- 3
- 4
- 5
Колба с отростком (колба Вюрца)
Эксикатор (прибор для высушивания и хранения гигроскопичных веществ)
Колба-приёмник
Аппарат Киппа
Прямой холодильник (холодильник Либиха)
Ответ: 1 — аппарат киппа 2 — колба Вюрца 3 — эксикатор 4 — прямой холодильник 5 — колба-приемник
Задание 2. Имеются 4 навески порошков металлов, все навески имеют одинаковую массу. Металлы – железо, цинк, алюминий, магний. Металлы сожгли в избытке кислорода и взвесили продукты сгорания. Запишите формулы продуктов сгорания и расположите их в порядке возрастания массы.
Продукт 1 (наименьшая масса)
Задание 3. Продукт 2
Задание 4. Продукт 3
Задание 5. Продукт 4 (наибольшая масса)
Задание 6. В аппарат Киппа (на рис. показан цифрой 1) поместили кусочки мрамора и залили соляную кислоту. Выделился газ X, который пропустили в цилиндр с дистиллированной водой (на рисунке показан цифрой 2).
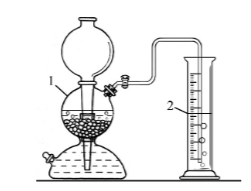
После пропускания газообразного вещества X масса цилиндра с водой увеличилась на 1,1 г. В цилиндр с раствором X добавили избыток известковой воды, наблюдали выпадение осадка белого цвета.
Какой газ X получали в аппарате Киппа? Приведите его химическую формулу.
Задание 7. Какова масса осадка, выпавшего после добавления избытка известковой воды к раствору газа X? Ответ выразите в граммах и округлите до десятых.
Задание 8. Выберите вещества, действуя на которые соляной кислотой, можно количественно получить хлорид цинка.
ZnBr2
Zn2(OH)2CO3
ZnO
Zn(NO3)2
Na2ZnO2
ZnSO4
Задание 9. Даны смеси газов (в неизвестных соотношениях). Как изменится средняя молярная масса каждой смеси при протекании реакции между газами? Установите правильное соответствие.
- уменьшится
- увеличится
- не изменится
H2 и Cl2
CO и O2
N2 и H2
CO и N2O
Задание 10. Навеска металла массой 2,00 г полностью растворяется в избытке соляной кислоты с выделением газа, объём которого составляет 377 мл (в пересчёте на н.у.).
Определите металл, в ответе укажите его символ. Предложите два разных решения.
Металл 1 (с меньшей атомной массой) –
Металл 2 (с бо́льшей атомной массой) –
Задание 11. Рассчитайте массу продукта реакции соляной кислоты с более тяжёлым металлом. Ответ приведите в граммах, с точностью до десятых.
Задание 12. Вещество ионного строения состоит из двух элементов. Положительный и отрицательный ионы имеют одинаковую электронную конфигурацию. При взаимодействии вещества с водой выделяется газ, в молекуле которого столько же электронов, сколько в каждом из ионов по отдельности.
Определите неизвестные вещества и ионы, приведите их формулы. В формуле иона заряд указывайте после символа элемента.
Формула вещества ионного строения –
Формула газа –
Формула положительно заряженного иона –
Формула отрицательно заряженного иона –
Задание 13. Сколько электронов содержится в молекуле газа?
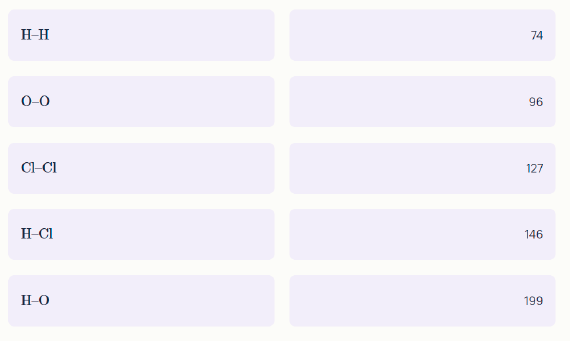
Задание 14. Химические связи бывают разные – короткие и длинные. Даны некоторые ковалентные связи и их длины (в относительных единицах). Каждой связи поставьте в соответствие правильную длину.
10 класс
Задание 1. В 1 моль вещества ионного строения содержится суммарно 3 моль ионов. Катионы и анионы имеют одинаковую электронную конфигурацию. Массовая доля катионов составляет 36,0 %. Определите вещество, приведите его формулу.
→ Получить ответы
Задание 2. При сжигании 0,1 моль простого вещества молекулярного строения образовалось 0,1 моль оксида Y, массовая доля кислорода в котором равна 43,6 %. Плотность паров этого вещества по воздуху равна 7,6.
Установите молекулярные формулы простого вещества и образующегося оксида.
Простое вещество –
Оксид –
→ Получить ответы
Задание 3. Сколько валентных электронов содержит атом элемента, образующего простое вещество?
→ Получить ответы
Задание 4. Укажите пространственное строение молекулы простого вещества.
правильный шестиугольник
тетраэдр
треугольник
квадрат
шар
октаэдр
куб
→ Получить ответы
Задание 5. При электролизе водного раствора натриевой соли одноосновной предельной карбоновой кислоты с неразветвлённым скелетом на аноде образовались газ и жидкость, массовая доля углерода в которой составляет 83,7 %. Установите формулы исходной соли, жидкости и газообразного продукта сплавления твёрдой соли с избытком гидроксида натрия.
Пример записи формулы соли: C40H81COONa.
Запишите формулу исходной соли.
→ Получить ответы
Задание 6. Запишите формулу жидкости.
→ Получить ответы
Задание 7. Запишите формулу газообразного продукта сплавления.
→ Получить ответы
Задание 8. Соединение с молекулярной формулой C4H8Br2 не имеет оптических изомеров, а при нагревании со спиртовым раствором щелочи образует единственный органический продукт – вещество состава C4H6, которое легко полимеризуется. Установите структуры упомянутых в условии веществ и ответьте на вопросы.
Укажите номера атомов углерода в названии исходного соединения, с которыми соединены атомы брома.
→ Получить ответы
Задание 9. Сколько двойных связей содержит продукт C4H6? В поле ответа введите число, если двойных связей нет, введите 0.
→ Получить ответы
Задание 10. Сколько двойных связей содержит элементарное звено полимера, который получается из C4H6? В поле ответа введите число, если двойных связей нет, введите 0.
→ Получить ответы
Задание 11. Одним из способов определения влаги в строительных образцах является карбидный метод. Исследуемый образец, ампулу с карбидом кальция (CaC2) и несколько металлических шариков помещают в прочный стальной сосуд. Сосуд закрывают крышкой, в которую вмонтирован манометр. Давление в сосуде приводят к атмосферному. После встряхивания сосуда металлические шарики разбивают стеклянную ампулу и карбид кальция начинает реагировать с влагой в образце.
Какой газ выделяется в ходе реакции? В ответ запишите формулу этого газа.
50 г исследуемого образца плотностью 2 г/см3, ампулу карбида кальция объёмом 15 см3 и металлические шарики общим объёмом 3,5 см3 поместили в сосуд объёмом 700 см3. Считайте, что эти объёмы не меняются в ходе эксперимента. Сосуд закрыли, привели давление внутри сосуда к атмосферному и затем встряхнули. После окончания реакции давление в сосуде увеличилось настолько, что молярный объём газа по окончании измерения стал равен 8,15 л/моль.
Рассчитайте массовую долю воды (%) в исследуемом образце. В ответ запишите число, округлив его до десятых.
→ Получить ответы
Задание 12. Одним из источников энергии на космических станциях может служить реакция αα-распада плутония-238. Изотоп какого элемента (помимо α-частицы) образуется в ходе данной реакции?
В ответ запишите обозначение этого элемента, используя латинские буквы.
→ Получить ответы
Задание 13. Запишите массовое число изотопа этого элемента.
→ Получить ответы
Задание 14. В результате распада 1 моль плутония-238 выделяется 6,4 · 108 кДж энергии.
Рассчитайте массу (в т) авиационного бензина Б-70 с удельной теплотой сгорания 44,1 МДж/кг, который необходимо сжечь, чтобы выделилось такое же количество энергии. Ответ округлите до десятых.
→ Получить ответы
Задание 15. Для расчета массы металла, который выделяется на катоде в процессе электролиза, используют закон Фарадея:
→ Получить ответы
Задание 2. При сжигании 0,1 моль простого вещества молекулярного строения образовалось 0,1 моль оксида Y, массовая доля кислорода в котором равна 43,6 %. Плотность паров этого вещества по воздуху равна 7,6.
Установите молекулярные формулы простого вещества и образующегося оксида.
Простое вещество –
Оксид –
→ Получить ответы
Задание 3. Сколько валентных электронов содержит атом элемента, образующего простое вещество?
→ Получить ответы
Задание 4. Укажите пространственное строение молекулы простого вещества.
правильный шестиугольник
тетраэдр
треугольник
квадрат
шар
октаэдр
куб
→ Получить ответы
Задание 5. При электролизе водного раствора натриевой соли одноосновной предельной карбоновой кислоты с неразветвлённым скелетом на аноде образовались газ и жидкость, массовая доля углерода в которой составляет 83,7 %. Установите формулы исходной соли, жидкости и газообразного продукта сплавления твёрдой соли с избытком гидроксида натрия.
Пример записи формулы соли: C40H81COONa.
Запишите формулу исходной соли.
→ Получить ответы
Задание 6. Запишите формулу жидкости.
→ Получить ответы
Задание 7. Запишите формулу газообразного продукта сплавления.
→ Получить ответы
Задание 8. Соединение с молекулярной формулой C4H8Br2 не имеет оптических изомеров, а при нагревании со спиртовым раствором щелочи образует единственный органический продукт – вещество состава C4H6, которое легко полимеризуется. Установите структуры упомянутых в условии веществ и ответьте на вопросы.
Укажите номера атомов углерода в названии исходного соединения, с которыми соединены атомы брома.
→ Получить ответы
Задание 9. Сколько двойных связей содержит продукт C4H6? В поле ответа введите число, если двойных связей нет, введите 0.
→ Получить ответы
Задание 10. Сколько двойных связей содержит элементарное звено полимера, который получается из C4H6? В поле ответа введите число, если двойных связей нет, введите 0.
→ Получить ответы
Задание 11. Одним из способов определения влаги в строительных образцах является карбидный метод. Исследуемый образец, ампулу с карбидом кальция (CaC2) и несколько металлических шариков помещают в прочный стальной сосуд. Сосуд закрывают крышкой, в которую вмонтирован манометр. Давление в сосуде приводят к атмосферному. После встряхивания сосуда металлические шарики разбивают стеклянную ампулу и карбид кальция начинает реагировать с влагой в образце.
Какой газ выделяется в ходе реакции? В ответ запишите формулу этого газа.
50 г исследуемого образца плотностью 2 г/см3, ампулу карбида кальция объёмом 15 см3 и металлические шарики общим объёмом 3,5 см3 поместили в сосуд объёмом 700 см3. Считайте, что эти объёмы не меняются в ходе эксперимента. Сосуд закрыли, привели давление внутри сосуда к атмосферному и затем встряхнули. После окончания реакции давление в сосуде увеличилось настолько, что молярный объём газа по окончании измерения стал равен 8,15 л/моль.
Рассчитайте массовую долю воды (%) в исследуемом образце. В ответ запишите число, округлив его до десятых.
→ Получить ответы
Задание 12. Одним из источников энергии на космических станциях может служить реакция αα-распада плутония-238. Изотоп какого элемента (помимо α-частицы) образуется в ходе данной реакции?
В ответ запишите обозначение этого элемента, используя латинские буквы.
→ Получить ответы
Задание 13. Запишите массовое число изотопа этого элемента.
→ Получить ответы
Задание 14. В результате распада 1 моль плутония-238 выделяется 6,4 · 108 кДж энергии.
Рассчитайте массу (в т) авиационного бензина Б-70 с удельной теплотой сгорания 44,1 МДж/кг, который необходимо сжечь, чтобы выделилось такое же количество энергии. Ответ округлите до десятых.
→ Получить ответы
Задание 15. Для расчета массы металла, который выделяется на катоде в процессе электролиза, используют закон Фарадея:
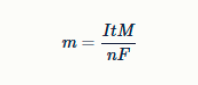
где
m – масса выделившегося металла, г
I – сила тока, А
t – время проведения электролиза, с
M – молярная масса металла, г/моль
F ≈ 96500 Кл/моль – постоянная Фарадея
n – количество электронов, участвующих в восстановлении иона металла до металла.
В раствор соли нитрата одновалентного металла опустили электроды и начали пропускать ток силой 8 А в течение 1 часа, при этом выделилось 14,5 г металла. Определите металл, если выход реакции составил 45 %, а электролиз проводили до тех пор, пока не прекратилось выделение металла. В ответ запишите символ металла.
11 класс
Задание 1. Бесцветное кристаллическое вещество массой 6,00 г сожгли в кислороде, получив при этом 4,40 г углекислого газа, 2,24 л (н.у.) азота и 3,60 г воды. А при нагревании 6,00 г этого вещества с избытком раствора гидроксида калия выделяется 4,48 л (н.у.) аммиака.
Установите молекулярную формулу вещества (в формате CxHyNzOa, единичный индекс не записывается).
→ Получить ответы
Задание 2. Запишите тривиальное название вещества.
→ Получить ответы
Задание 3. Найдите сумму минимальных целочисленных коэффициентов в реакции вещества с гидроксидом калия.
→ Получить ответы
Задание 4. Вещества А и Б ионного строения имеют одинаковые молярные массы, а 1 моль каждого вещества содержит суммарно 3 моль ионов. Все ионы в обоих веществах имеют одинаковую электронную конфигурацию. Массовая доля катионов в веществе А равна 74,2 %, массовая доля катионов в веществе Б составляет 38,7 % %.Определите вещества А и Б. В ответе запишите их формулы.
Вещество А –
Вещество Б –
→ Получить ответы
Задание 5. Запишите молярную массу этих веществ (в г/моль, с точностью до целых).
→ Получить ответы
Задание 6. Простые вещества X и Y, соответствующие элементам-неметаллам одной группы, имеют атомное строение и одинаковую кристаллическую структуру. В этих кристаллах все атомы четырёхвалентны, а все связи – одинарные. Первое вещество растворяется в концентрированной азотной кислоте, но не реагирует с концентрированной щелочью, а второе – наоборот.
Запишите формулы простых веществ X и Y.
Вещество X –
Вещество Y –
→ Получить ответы
Задание 7. Сколько молей химических связей содержится в 42 г X? Ответ – натуральное число.
→ Получить ответы
Задание 8. Сколько молей химических связей содержится в 42 г Y? Ответ – натуральное число.
→ Получить ответы
Задание 9. Дана схема превращений:
CnH2nOn→ X →C3H8O→ Y →C3H5O2Cl→ Z →CmH2mOm
Известно, что m=3n, а вещество Z содержит азот. Расшифруйте схему.
Найдите значения m и n.
m =
n =
→ Получить ответы
Задание 10. Приведите молекулярную формулу вещества Z (в формате CxHyNzOa, единичный индекс не записывается).
→ Получить ответы
Задание 11. Напишите формулу реагента, который используется на последней стадии.
→ Получить ответы
Задание 12. В пяти пронумерованных пробирках находятся твёрдые белые порошки нерастворимых в воде веществ. Чтобы определить содержимое пробирок, с ними провели ряд экспериментов, результаты которых представлены в виде таблицы:
Установите молекулярную формулу вещества (в формате CxHyNzOa, единичный индекс не записывается).
→ Получить ответы
Задание 2. Запишите тривиальное название вещества.
→ Получить ответы
Задание 3. Найдите сумму минимальных целочисленных коэффициентов в реакции вещества с гидроксидом калия.
→ Получить ответы
Задание 4. Вещества А и Б ионного строения имеют одинаковые молярные массы, а 1 моль каждого вещества содержит суммарно 3 моль ионов. Все ионы в обоих веществах имеют одинаковую электронную конфигурацию. Массовая доля катионов в веществе А равна 74,2 %, массовая доля катионов в веществе Б составляет 38,7 % %.Определите вещества А и Б. В ответе запишите их формулы.
Вещество А –
Вещество Б –
→ Получить ответы
Задание 5. Запишите молярную массу этих веществ (в г/моль, с точностью до целых).
→ Получить ответы
Задание 6. Простые вещества X и Y, соответствующие элементам-неметаллам одной группы, имеют атомное строение и одинаковую кристаллическую структуру. В этих кристаллах все атомы четырёхвалентны, а все связи – одинарные. Первое вещество растворяется в концентрированной азотной кислоте, но не реагирует с концентрированной щелочью, а второе – наоборот.
Запишите формулы простых веществ X и Y.
Вещество X –
Вещество Y –
→ Получить ответы
Задание 7. Сколько молей химических связей содержится в 42 г X? Ответ – натуральное число.
→ Получить ответы
Задание 8. Сколько молей химических связей содержится в 42 г Y? Ответ – натуральное число.
→ Получить ответы
Задание 9. Дана схема превращений:
CnH2nOn→ X →C3H8O→ Y →C3H5O2Cl→ Z →CmH2mOm
Известно, что m=3n, а вещество Z содержит азот. Расшифруйте схему.
Найдите значения m и n.
m =
n =
→ Получить ответы
Задание 10. Приведите молекулярную формулу вещества Z (в формате CxHyNzOa, единичный индекс не записывается).
→ Получить ответы
Задание 11. Напишите формулу реагента, который используется на последней стадии.
→ Получить ответы
Задание 12. В пяти пронумерованных пробирках находятся твёрдые белые порошки нерастворимых в воде веществ. Чтобы определить содержимое пробирок, с ними провели ряд экспериментов, результаты которых представлены в виде таблицы:
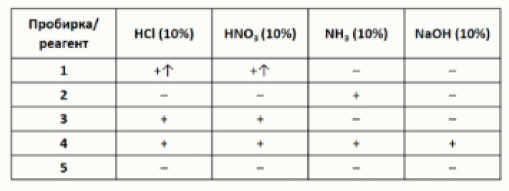
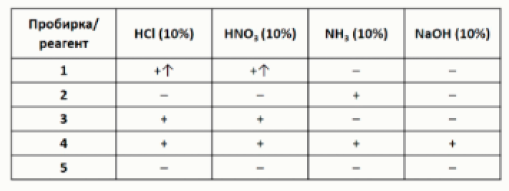
+ – растворение
– – отсутствие видимых изменений
↑ – выделение газа
Определите содержимое пробирок, установив соответствие между номером пробирки и формулой
вещества.
→ Получить ответы
Задание 13. Установите соответствие между предметом и полимером, из которого его изготавливают.
→ Получить ответы
Задание 14-18. Выберите ВСЕ вещества, которые могут являться продуктами реакции (не обязательно главными).
– – отсутствие видимых изменений
↑ – выделение газа
Определите содержимое пробирок, установив соответствие между номером пробирки и формулой
вещества.
- 1
- 2
- 3
- 4
- 5
- BaSO4
- Al(OH)3
- Ba3(PO4)2
- AgCl
- ZnO
- CaCO3
- FeS
→ Получить ответы
Задание 13. Установите соответствие между предметом и полимером, из которого его изготавливают.
- Одноразовые вилки и ложки
- Пищевая плёнка
- Пластиковые бутылки для воды
- Изолента
- Пластиковое покрытие линолеума
- полиэтилентерефталат
- полипропилен
- поливинилацетат
- поливинилхлорид
- полиэтилен
→ Получить ответы
Задание 14-18. Выберите ВСЕ вещества, которые могут являться продуктами реакции (не обязательно главными).
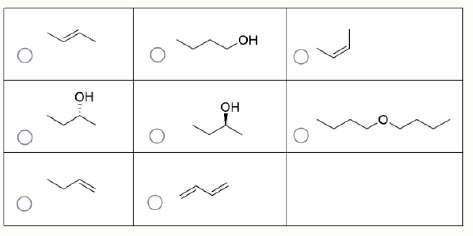
Задание 19. Иодометрия – это важный титриметрический метод определения концентраций окислителей. Для проведения данного анализа к алквоте раствора окислителя добавляют избыток раствора иодида калия, после чего выделившийся в ходе окислительно-восстановительной реакции иод титруют стандартным раствором тиосульфата натрия. Для
иодометрического определения взяли одинаковые алквоты 2,00 % водных растворов:
Расположите растворы окислителей в порядке уменьшения (от наибольшего к
наименьшему) объёма раствора тиосульфата натрия, который пойдёт на титрование иода,
выделившегося при взаимодействии их алквот с подкисленным раствором иодида калия.
Плотности всех растворов примите равными 1 г/см³.
→ Получить ответы
иодометрического определения взяли одинаковые алквоты 2,00 % водных растворов:
- перманганата калия;
- дихромата аммония;
- бромата натрия;
- пероксида водорода.
Расположите растворы окислителей в порядке уменьшения (от наибольшего к
наименьшему) объёма раствора тиосульфата натрия, который пойдёт на титрование иода,
выделившегося при взаимодействии их алквот с подкисленным раствором иодида калия.
Плотности всех растворов примите равными 1 г/см³.
→ Получить ответы
Задание 20-23. В ходе лабораторной работы по химии в 10 классе при изучении курса органической химии учитель Колбочкин предложил учащимся взять высококалорийный пищевой продукт X (который можно легко купить в продуктовых магазинах или фермерских лавках) и нагреть его вместе с концентрированным раствором гидроксида натрия. При этом образуются смесь органических веществ одного класса и органическое вещество Z. Компонент смеси Y содержит 18 атомов углерода. Продукт взаимодействия вещества Y с соляной кислотой не реагирует с бромной водой. Вещество Y способствует умягчению жёсткой воды. Вещество Z используется в косметологии, при его нагревании с кристаллическим гидросульфатом калия образуется органическое вещество Q (массовая доля углерода 64,3 %, массовая доля водорода 7,1 %), которое может присоединять бром и реагировать с реактивом Толленса (аммиачным раствором оксида серебра) с образованием осадка простого вещества.
Как называется пищевой продукт X? В ответ запишите одно слово.
Какова среда водного раствора вещества Y?
Чему равна молярная масса вещества Z? Дайте ответ в г/моль с точностью до целых.
Назовите вещество Q по правилам ИЮПАК.
Как называется пищевой продукт X? В ответ запишите одно слово.
Какова среда водного раствора вещества Y?
Чему равна молярная масса вещества Z? Дайте ответ в г/моль с точностью до целых.
Назовите вещество Q по правилам ИЮПАК.
Часть ответов по ВсОШ публикуется бесплатно в нашем Telegram-канале: @shcolaotvet